Ángel Ramos, Ana Isabel Lorenzo, Sol Ferrán, Manuel Manrique
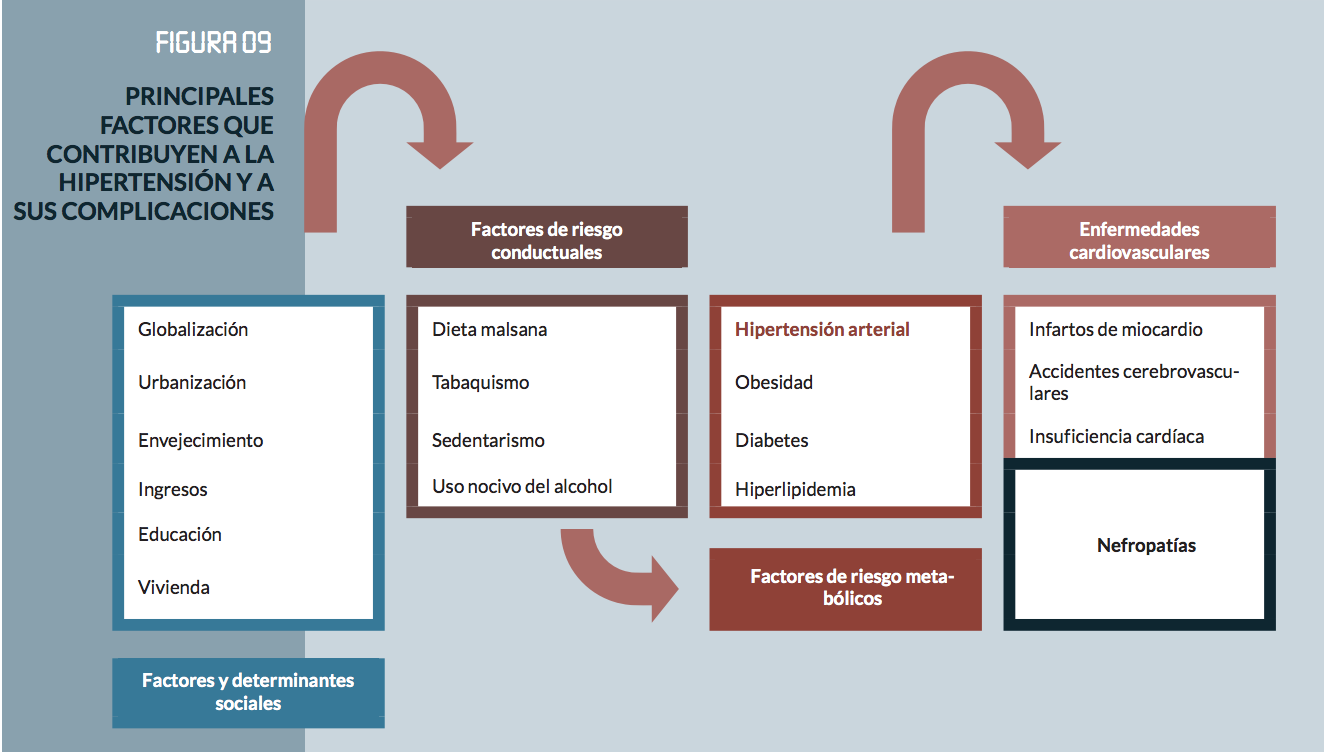
Factores de riesgo metabólicos
Diabetes
Autor: Ángel Ramos
La evidencia actual sustenta una potente relación entre la hipoacusia leve-subclínica en la diabetes mellitus (DM), tanto tipo I como tipo II. Además, parece ser que el control glucémico, el tiempo de evolución del mismo y la presencia de comorbilidades o complicaciones pueden ser factores predictores de desarrollo de hipoacusia. Sin embargo, es destacable que la mayor potencia estadística de asociación entre diabetes e hipoacusia ocurre en pacientes jóvenes, particularmente estudiado en diabetes tipo I, al evitar el factor de confusión de la hipoacusia asociada a la edad. Por otro lado, parece que la diabetes mellitus está asociada de forma significativa con el aumento del riesgo de desarrollar hipoacusia súbita, más si se tratan de enfermos con mal control glucémico.
La implicación de la DM en la pérdida de audición está evidenciada en la mayoría de los artículos revisados. Oh et al.1, encontraron que la edad y la DM estaban correlacionadas con la prevalencia de pérdida de audición, y mostró que la DM era un predictor significativo de pérdida auditiva (OR 1.398). En este estudio, se evidenció que la hipoacusia debido a la edad (presbiacusia) comienza en frecuencias altas, y progresivamente alcanza a las frecuencias medias, y a las bajas.
Rolim et al.2 realizan un estudio para demostrar si en pacientes con DM e HTA tenía lugar una pérdida de audición acelerada con respecto a individuos sin estas enfermedades. Para ello, llevaron a cabo dos estudios audiométricos con un intervalo de 3-4 años, encontrando diferencias estadísticamente significativas para el grupo de HTA a partir de 4kHz, y para el grupo de DM e HTA en frecuencias de 500, 2kHz, 3kHz y 8kHz.
Besser et al.3 recogen estudios que revelan una mayor prevalencia de hipoacusia en frecuencias altas y medias-bajas en pacientes con una glucosa basal alterada comparada con individuos con niveles normales de glucosa, así como individuos con una hemoglobina glicosilada alta.
Las relaciones causales todavía no están establecidas, aunque se ha sugerido que la fisiopatología responsable esté mediada por daño a la cóclea por trastornos circulatorios del oído interno; alteración en la actividad de la bomba ATPasa encontrada en la estría vascular debido a cambios en el flujo sanguíneo, dando lugar a un aumento de la concentración de sodio en la endolinfa, produciendo cambio en el potencial de acción endococlear; pérdida de audición retrococlear causada por neuritis del nervio auditivo; la aparición de neuropatía diabética; y mutaciones de ADN mitocondrial.
Referencias Diabetes
- Oh I-H, Lee JH, Park DC, Kim M, Chung JH, Kim SH, et al. Hearing Loss as a Function of Aging and Diabetes Mellitus: A Cross Sectional Study. PLoS One [Internet]. [cited 2020 Feb 5].
- Rolim LP, Samelli AG, Moreira RR, Matas CG, Santos I de S, Bensenor IM, et al. Effects of diabetes mellitus and systemic arterial hypertension on elderly patients’ hearing. Braz J Otorhinolaryngol. 2018 Nov 1;84(6):754–63.
- Besser J, Stropahl M, Urry E, Launer S. Comorbidities of hearing loss and the implications of multimorbidity for audiological care. Vol. 369, Hearing Research. Elsevier B.V.; 2018. p. 3–14.
Hiperlipidemia
Autora: Ana Isabel Lorenzo
Los efectos de la hiperlipidemia (HLP) sobre la función auditiva se han investigado desde el primer informe que observó la relación entre la hiperlipidemia, la pérdida auditiva y los factores de riesgo cardiovascular en 1964.5 Se han hecho muchos intentos para describir la disfunción auditiva relacionada con la hiperlipidemia. Esta pérdida auditiva inducida por una condición patológica (HTA, HLP o ruido) se ha definido como una variante de la presbiacusia3,4, la hipoacusia neurosensorial en altas frecuencias3,5-7
Algunos autores encontraron que no hubo una asociación significativa entre la audición y los niveles de triglicéridos o colesterol en ayunas. Descubrieron que la pérdida auditiva no era mayor en una población cuyos lípidos en sangre en ayunas estaban elevados que en una población control7,8.
Pero la mayoría de autores muestran que existe una relación entre la hiperlipidemia y flujo sanguíneo. La lámina espiral y la estría vascular son las partes más vascularizadas del oído interno y consumen oxígeno en cantidades iguales a la retina9. La pérdida auditiva neurosensorial secundaria a hiperlipidemia puede estar relacionada con ateroesclerosis, embolia microvascular, factores hereditarios, hipertensión y envejecimiento7. Las paredes vasculares cocleares regulan el flujo sanguíneo coclear produciendo óxido nítrico, que tiene efecto vasodilatador10. El colesterol LDL (de baja densidad) puede impedir el flujo sanguíneo coclear al bloquear la producción de óxido nítrico en la pared vascular y reducir la motilidad de las células ciliadas externas1,3,11,21-24. Además, se propuso que la hipertrigliceridemia, la hipercolesterolemia y la hiperfibrinogenemia pueden conducir a una disminución del flujo sanguíneo coclear debido a la hiperviscosidad y los defectos vasculares resultantes de la ateroesclerosis.3,21
Estudios experimentales en dietas ricas en lípidos revelaron cambios patológicos en la estría vascular y en las células ciliadas externas con efectos aditivos cuando se asocia a HTA y colesterol elevado.1 Satar et al2 realizaron un estudio experimental en cerdos donde compararon a un grupo de control alimentado con una dieta normal, y un grupo de colesterol que recibió una dieta compuesta de 1 g de colesterol por día durante 4 meses. El grupo de control mostró estructuras cocleares normales con umbrales de audición normales, mientras que el grupo de colesterol tenía edema profundo en la capa marginal de la estría y edema leve en las células ciliadas externas, en línea con los datos de las respuestas auditivas del tronco encefálico que revelaban cambios en la sensibilidad auditiva.
Gatehouse et al.12 investigó la relación entre la hiperviscosidad y sus efectos sobre las funciones auditivas. A la luz de este estudio, se demostró que la hiperviscosidad puede conducir a una hipoacusia neurosensorial en frecuencias más altas, como 2–4 KHz. Se concluyó que la disfunción auditiva debido a hiperlipidemia puede atribuirse a la hiperviscosidad, la oclusión vascular y la mayor susceptibilidad al ruido.
Sikora et at.32 argumentó que una dieta alta en colesterol podría aumentar la susceptibilidad al ruido y provocar pérdida de audición en roedores. Axelsson y Lindgren14 observaron un riesgo ligeramente mayor de adquirir hipoacusia neurosensorial en frecuencias altas para las personas que trabajan en entornos ruidosos y que tienen niveles elevados de colesterol en suero. Erdem et al3 describen que las amplitudes reducidas de las OEA a 4 KHz en pacientes con hipertrigliceridemia son compatibles con el patrón de pérdida auditiva visto en la hiperviscosidad y la mayor susceptibilidad al ruido en pacientes con hiperlipidemia.
Suzuki et al.15 observaron que los niveles de audición eran mejores en 2 y 4 KHz en pacientes con colesterol de lipoproteína de alta densidad (HDL) más alto.
Wang et al16 en enero de 2020 concluyó que los niveles elevados en sangre de no-HDL colesterol está asociado a un mayor riesgo de hipoacusia neurosensorial súbita y que los niveles de no-HDL colesterol pueden servir como un biomarcador predictor de riesgo de hipoacusia súbita. De la misma forma Ballesteros17 y Aimoni18 proponen que la hipercolesterolemia y el IMC19 están asociados al riesgo de hipoacusia neurosensorial súbita.
Cai et al20, en el 2009 realizaron un estudio experimental en ratones donde comprobaron que los medicamentos utilizados para la prevención y el tratamiento del aterosclerosis, como la simvastatina, actúan como otoprotectores en ratones. Así mismo, Syka y col.25,22 sugirió como resultado de un estudio experimental en 34 ratones que la atorvastatina podría disminuir la progresión de la pérdida auditiva relacionada con la presbiacusia en ratones.
Diferentes estudios evaluaron el efecto de las estatinas sobre la función auditiva basándose en el argumento de que el grupo de las estatinas, que inhiben competitivamente la 3-hidroxi-3-metilglutaril coenzima A reductasa (HMG-COA reductasa) están asociados con una disminución de la viscosidad plasmática y la vasodilatación del óxido nítrico (ON) derivado del epitelio.22-24 Por lo tanto independientemente de los efectos reductores del colesterol, las estatinas afectan el endotelio vascular y aumentan la síntesis de ON, disminuyen la viscosidad de la sangre y regulan la microcirculación coclear.24,22 Estas observaciones dan lugar a la idea de que, con el uso de estatinas, los efectos microvasculares de la hiperlipidemia pueden reducirse19,22. Yucel et al22 en su estudio sobre el efecto de las estatinas en la función auditiva y la sensación subjetiva de acúfenos observó que a pesar de que hubo mejoría en los niveles auditivos en todos los grupos de estatinas a 6000Hz en la audiometría, no hubo diferencias estadísticamente significativas entre los grupos de estatinas en términos de mejoría en esta frecuencia. Sin embargo, se encontró una mejora estadísticamente significativa de aproximadamente 2 dB en los umbrales auditivos después del uso de estatinas a 6000 Hz. Pero esta diferencia era demasiado pequeña para ser clínicamente significativa y también este resultado podría deberse al técnico de audiometría o al paciente.
En contraposición a lo antes expuesto hay informes de que las estatinas pueden tener efectos negativos en la audición. En un estudio de Chung SD et al.27 donde examinaron la relación entre la hipoacusia neurosensorial súbita (HNSS) y el uso de estatinas, detectaron una relación estadísticamente significativa entre HNSS y el uso previo de estatinas, independientemente de si la estatina se usa regularmente. Olzowy y col.26 en un ensayo clínico doble ciego estudiaron el efecto de la atorvastatina en pacientes de edad avanzada sobre la pérdida auditiva y los acúfenos y no encontraron diferencias estadísticamente significativas en los umbrales auditivos, pero encontraron que podía disminuir la sensación subjetiva de los acúfenos.
Por otra parte la presencia de síndrome metabólico (SM) está asociado a un aumento de pérdida de audición.28-30 Se define el SM como la presencia de 3 o más de las siguientes características: 1. Circunferencia abdominal mayor o igual a 102 cm en hombres y mayor o igual a 88cm en mujeres, 2. Hipertrigliceridemia mayor o igual a 150mg/dl, 3. Niveles bajos de HDL < 40mg/dl en hombres y < 50mg/dl en mujeres, 4. Presión arterial elevada: sistólica mayor o igual a 130 mmHg o diastólica mayor o igual a 85 mmHg, 5. Glicemia elevadas mayor o igual a 20mg/dl. 28
Sun et al28 en 2015 encontraron que la presencia del síndrome metabólico se asoció significativamente con pérdida de audición en frecuencias altas y bajas, también observaron una relación positiva entre la pérdida de audición y un mayor número de componentes del síndrome metabólico, en especial un nivel bajo de HDL y un nivel alto de triglicéridos demostraron una asociación más fuerte con el aumento de pérdida de audición al igual que Shin et al29 quienes concluyen que a un mayor número de componentes de SM mayor riesgo de pérdida de audición. Zhang et al31 en 2019 argumentaron que el SM afecta negativamente a la recuperación de la hipoacusia neurosensorial súbita y que estos pacientes tenían peores pronósticos con el aumento más componentes del SM.
Por todo ello se concluye que:
- Existe una relación directa entre la dislipemia y la hipoacusia neurosensorial en frecuencias altas.
- La dislipemia aumenta la hiperviscosidad, disminuye la vasodilatación al disminuir el óxido nítrico y disminuye el flujo sanguíneo coclear.
- La dislipemia aumenta el riesgo de hipoacusia neurosensorial en expuestos al ruido.
- El HDL alto parece proteger la pérdida auditiva. 5-Las estatinas tienen un efecto protector y pueden minimizar los efectos microvasculares de la dislipemia.
Referencias Hiperlipidemia
- Chávez-Delgado ME, Vázquez-Granados I, Rosales-Cortés M, Velasco-Rodríguez V. Disfunción cócleo-vestibular en pacientes con diabetes mellitus, hipertensión arterial sistémica y dislipidemia. Acta Otorrinolaringol Esp. 2012;63(2):93–101.
- Satar B, Ozkaptan Y, Sürücü HS, Oztürk H. Ultrastructural effects of hypercholesterolemia on the cochlea. Otol Neurotol. 2001;22(6):786–789.
- Erdem, T., Ozturan, O., Miman, M. et al. Exploration of the early auditory effects of hyperlipoproteinemia and diabetes mellitus using otoacoustic emissions. Eur Arch Otorhinolaryngol 260, 62–66 (2003)
- Cunningham DR, Goetzinger CP (1974) Extra-high frequency hearing loss and hyperlipidemia. Audiology 13: 470–484
- Rosen S, Plester D, El-Mofty A, Rosen HV (1964) Relation of hearing loss to cardiovascular disease. Trans Am Acad Ophtal- mol Otolaryngol 68: 433–444
- Spencer JT (1975) Hyperlipoprotenemia and inner ear disease. Otolaryngol Clin North Am 8: 483–492
- Jones NS, Davis A (1999) A prospective case-controlled study of patients presenting with idipatic sensorineural hearing loss to examine the relationship between hyperlipidemia and sensorineural hearing loss. Clin Otolaryngol 24: 531–536
- Jorgensen M, Buch H (1961) Studies on inner-ear function and cranial nerves in diabetes. Acta Otolaryngol 74: 373–381
- Spencer JT (1973) Hyperlipoprotenemia in the etiology of in- ner ear disease. Laryngoscope 83: 639–678
- Brechtelsbauer P, Nuttal A, Miller J (1994) Basal nitric oxide production in regulation of cochlear blood flow. Hear Res 77: 38–42
- Seiler C, Hess OM, Buechi M, Suter TM, Krayenbuelh HP (1993) Influence of serum cholesterol and other coronary risk factors on vasomotion of angiographically normal coronary ar- teries. Circulation 88: 2139–2148
- Gatehouse S, Gallcher JEJ, Lowe GDO, Yarnel JWG, Hutton RD, Isy?ng I (1989) Blood viscosity and hearing levels in the caerphilly collaborative heart disease study. Arch Otolaryngol Head Neck Surg 115: 1227–1230
- Seiler C, Hess OM, Buechi M, Suter TM, Krayenbuelh HP (1993) Influence of serum cholesterol and other coronary risk factors on vasomotion of angiographically normal coronary ar- teries. Circulation 88: 2139–2148
- Axelsson A, Lindgren F (1985) Is there a relationship betwen hypercholesterolemia and noise-indused hearing loss? Acta Otolaryngol (Stockh) 100: 379–386
- Suzuki K, Kaneko M, Murai K (2000) Influence of serum lipids on auditory function. Laryngoscope 110: 1736–1738
- Wang S, Ye Q, Pan Y. Serum non-high-density lipoprotein cholesterol is associated with the risk of sudden sensorineural hearing loss. Medicine (Baltimore). 2020;99(7):e19175.
- Ballesteros F, Alobid I, Tassies D, et al. Is there an overlap between sudden neurosensorial hearing loss and cardiovascular risk factors? Audiol Neurootol 2009;14:139–45.
- Aimoni C, Bianchini C, Borin M, et al. Diabetes, cardiovascular risk factors and idiopathic sudden sensorineural hearing loss: a case-control study. Audiol Neurootol 2010;15:111–5.
- Lee JS, Kim DH, Lee HJ, et al. Lipid profiles and obesity as potential risk factors of sudden sensorineural hearing loss. PLoS One. 2015;10(4):e0122496. Published 2015 Apr 10. doi:10.1371/journal.pone.0122496
- Cai Q, Du X, Zhou B, et al. Effects of simvastatin on plasma lipoproteins and hearing loss in apolipoprotein E gene-deficient mice. ORL J Otorhinolaryngol Relat Spec. 2009;71(5):244–250. doi:10.1159/000236014
- Malgrange B, Varela-Nieto I, de Medina P, Paillasse MR. Targeting cholesterol homeostasis to fight hearing loss: a new perspective. Front Aging Neurosci. 2015;7:3. Published 2015 Jan 29.
- Yücel H, Yücel A, Arba? H, Cure E, Eryilmaz MA, Özer AB. Effect of statins on hearing function and subjective tinnitus in hyperlipidemic patients. Rom J Intern Med. 2019;57(2):133–140.
- Maron DJ., Fazio S., Linton MF. Current perspectives on Statins. Circulation. 2000; 18;101(2):207-13.
- Feron O., Dessy C., Desager JP., Balligand JL. Hydroxy-methylglutaryl- coenzyme A reductase inhibition promotes endothelial nitric oxide synthase activation through a decrease in caveolin abundance. Circulation. 2001;103(1):113-8.
- Syka J., Ouda L., Nachtigal P., Solichova D., Semecky? V. Atorvastatin slows down deterioration of inner ear function with age in mice. Neurosci Lett. 2007;411(2):112-6.
- Olzowy B., Canis M., Hempel JM., Mazurek B., Suckfull M. Effect of atorvastatin on progression of sensorineural hearing loss and tinnitus in the elderly. Otol Neurotol. 2007;28(4):455-8.
- Chung SD., Chen CH., Hung SH., Lin HC., Wanglh. A population-based study on the association between statin use and sudden sensorineural hearing loss. Otolaryngol Head Neck Surg. 2015;152(2):319-25.
- Sun YS, Fang WH, Kao TW, et al. Components of Metabolic Syndrome as Risk Factors for Hearing Threshold Shifts. PLoS One. 2015;10(8):e0134388. Published 2015 Aug 6.
- Shim HS, Shin HJ, Kim MG, et al. Metabolic syndrome is associated with hearing disturbance. Acta Otolaryngol. 2019;139(1):42–47.
- Han X, Wang Z, Wang J, et al. Metabolic syndrome is associated with hearing loss among a middle-aged and older Chinese population: a cross-sectional study [published correction appears in Ann Med. 2018 Nov;50(7):636]. Ann Med. 2018;50(7):587–595.
- Zhang Y, Jiang Q, Wu X, Xie S, Feng Y, Sun H. The Influence of Metabolic Syndrome on the Prognosis of Idiopathic Sudden Sensorineural Hearing Loss. Otol Neurotol. 2019;40(8):994–997.
Hipertensión arterial
Autores: Ana Isabel Lorenzo, Sol Ferrán, Manuel Manrique
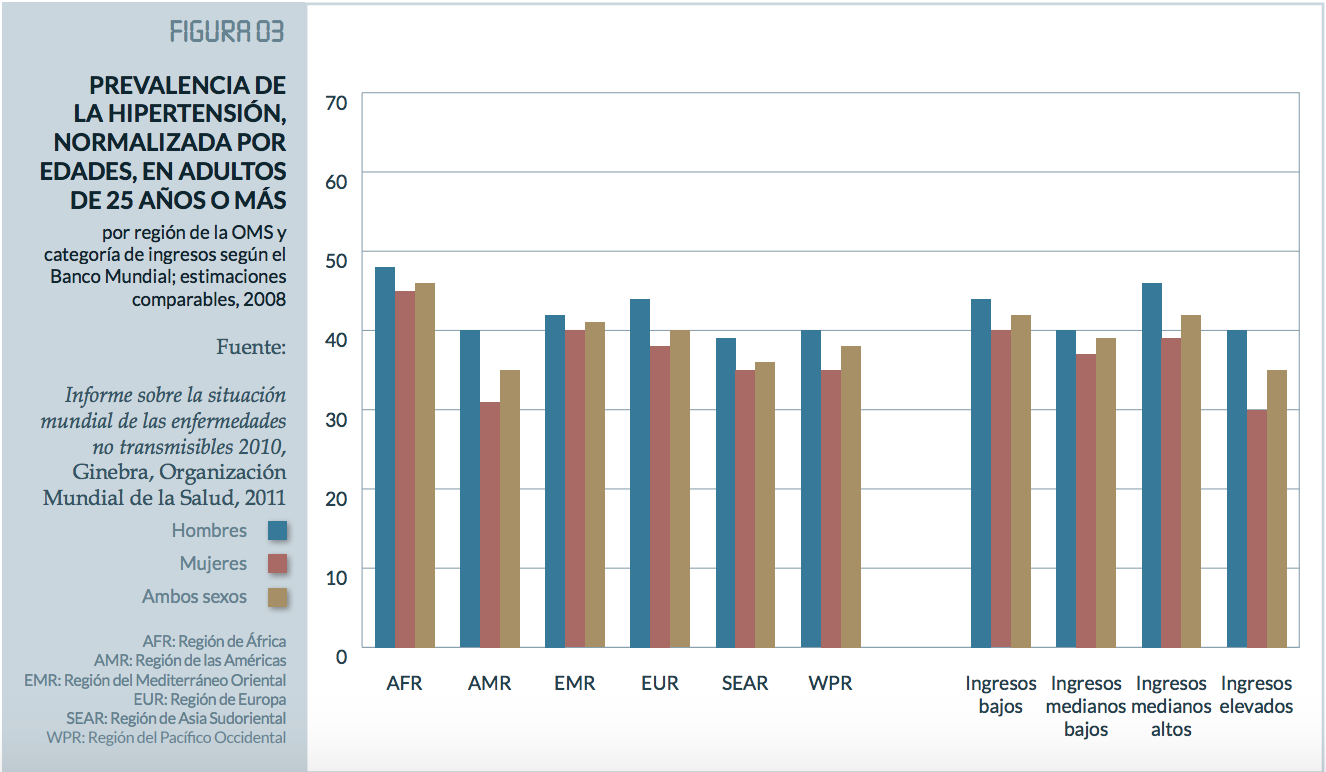
La hipertensión arterial (HTA) es la enfermedad crónica más frecuente en adultos. La prevalencia mundial de la hipertensión (definida como presión arterial sistólica y/o diastólica igual o superior a 140/90 mm Hg) en adultos de 18 años o más fue de un 22% en 2014, según el último informe de la OMS1. La máxima prevalencia de hipertensión se registra en la Región de África, con un 46% de los adultos mayores de 25 años, mientras que la más baja se observa en la Región de las Américas, con un 35%1. En general, la prevalencia de la hipertensión es menor en los países de ingresos elevados (35%) que, en los países de otros grupos de ingresos, en los que es del 40%1. En nuestro país, son 11 millones de personas (el 36,7% según la OMS) las que padecen esta enfermedad.
Según la OMS, más del 5% de la población mundial, o 466 millones de personas, tiene pérdida auditiva incapacitante (432 millones de adultos y 34 millones de niños). Se estima que para 2050 más de 900 millones de personas, o una de cada diez personas, tendrán una pérdida auditiva incapacitante. La pérdida auditiva discapacitante se refiere a la pérdida auditiva mayor de 40 decibelios (dB) en el oído con mejor nivel auditivo en adultos y una pérdida auditiva mayor de 30 dB en el oído con mejor nivel auditivo en niños. La mayoría de las personas con pérdida auditiva discapacitante viven en países de bajos y medianos ingresos. Aproximadamente un tercio de las personas mayores de 65 años se ven afectadas por la discapacidad auditiva. La prevalencia en este grupo de edad es mayor en el sur de Asia, Asia Pacífico y África subsahariana. En España, la sordera afecta a más de un millón de personas (de las que casi el 72% tienen más de 65 años) y entre uno y cinco recién nacidos de cada mil nacen con algún tipo de sordera.
En un estudio, Rosen y Olin (1964) encontraron que las personas de 40 a 59 años con enfermedad cardíaca tenían una sensibilidad auditiva más pobre que las personas de edad similar sin enfermedad cardíaca5,35
La hipótesis del efecto perjudicial de la hipertensión arterial sobre la cóclea y el sistema vestibular se desarrolló en 1968 en un estudio realizado por Hansen et al2 Desde entonces se han realizado múltiples estudios con resultados dispares.3,35
Se han realizado estudios experimentales con animales que concluyen que mantener un flujo sanguíneo adecuado en la cóclea es crítico para la función coclear y cualquier reducción en el suministro de sangre tendrá una reducción correspondiente en la función coclear y puede desarrollar un daño irreversible en la integridad de la cóclea.5
Tan et al6 exponen en su estudio sobre la pérdida de audición y la retinopatía hipertensiva que los pacientes con retinopatía hipertensiva tenían peores umbrales audiológicos en frecuencias altas y concluyen que la afectación vascular que se puede observar en pacientes con hipertensión mal controlada se asocia a pérdida de audición en frecuencias altas. Los autores sugieren que es la micro-angiopatía hipertensiva en la cóclea y en la retina lo que produce pérdida de audición y de agudeza visual respectivamente.
Nazar et al7, llevaron a cabo un estudio donde controlaron y trataron a 217 pacientes con HTA sin DM, sin exposición a ruido ni drogas ototóxicas durante 3 años y los compararon con un grupo control sano, y el análisis comparativo de los resultados de ambos grupos no revelo diferencias significativas, permitiendo postular que el perfil audiométrico en la población hipertensa crónica bien controlada es similar al de la población general.
Por otra parte, Marchiori et al9 estudiaron la asociación entre la hipertensión arterial y la pérdida de audición. Concluyen que existe una asociación significativa entre la hipertensión arterial y la pérdida de audición, y sugieren que la hipertensión es un factor acelerador de la degeneración del aparato auditivo debido al envejecimiento9,10,11. Así mismo describen que la HTA, la edad avanzada, el sexo masculino y la exposición a ruido son factores de riesgo independientes para la pérdida de audición.6,34 De igual modo Chen et al4 estudiaron la relación entre la hipertensión arterial y las alteraciones auditivas en personas mayores y exponen que la hipertensión asociada a niveles altos de triglicéridos y colesterol empeora la audición en personas mayores. Las alteraciones auditivas en personas mayores pueden ser el resultado de una HTA de larga duración y de sus complicaciones.
Borg et al8 realizaron un estudio experimental donde se expone a ambiente ruidoso a dos grupos de ratas (normotensas e hipertensas, respectivamente) y concluyen que el grupo de ratas normotensas no tenía apenas pérdida de células ciliadas en contraste con el grupo de ratas hipertensas donde se encontró mayor pérdida de las mismas. Tachibana et al12 publicó otro estudio en ratas en el que reveló que el sitio primario del deterioro coclear es la estría vascular, seguido por el órgano de Corti.
Por otro lado, Makishima et al13 estudiaron histopatológicamente 80 huesos temporales de 40 pacientes mayores de 50 años, prestando especial atención a los cambios angioscleróticos. Los hallazgos histopatológicos se correlacionaron con registros audiométricos y manométricos obtenidos mientras los pacientes estaban vivos. Demostraron que existe una considerable relación entre el estrechamiento de la luz de la arteria auditiva interna, la atrofia del ganglio espiral y la pérdida auditiva.
Así mismo Esparza et al14 en su estudio sobre la disfunción del oído interno y la presión arterial, sugieren que los pacientes con HTA pueden tener disfunción coclear asociada a la enfermedad vascular motivada por la HTA, la cual puede ser silente y sin clara evidencia de disfunción vestibular.
Varias investigaciones muestran que la pérdida auditiva sucede con la edad y está asociada a una microcirculación inadecuada bien por oclusión vascular, émbolos, hemorragia o vasoespasmos15. Otros autores atribuyen la pérdida de audición a hiperviscosidad o microangiopatía en relación a DM, HTA y a la asociación de varias patologías. 11,15,32
La fisiopatología de la pérdida de audición en relación con la HTA es multifactorial. El daño producido en la estría vascular que está altamente vascularizada se ha propuesto como un mecanismo indirecto de pérdida de audición. La función normal de la estría vascular es necesaria para mantener la homeostasis del oído interno. La pérdida de tejido estrial interrumpe la producción y la recaptación de potasio, lo que se traduce en un deterioro de la transducción de señales y posiblemente aumenta la producción de radicales libres en el oído interno17,18. Todo esto produce un entorno de estrés oxidativo y de hipoxia con el consecuente daño capilar.
Además, la estría vascular que corresponde a las frecuencias altas de la cóclea es particularmente vulnerable a la degeneración capilar y adelgazamiento de la membrana basal debido a alteraciones en el aporte sanguíneo coclear. Esta combinación de cambios en la homeostasis secundario a la hipertensión puede aumentar el efecto negativo de factores extrínsecos, como la exposición excesiva al ruido, y da como resultado una hipoacusia acelerada en las frecuencias altas en un área de la cóclea organizada tonotópicamente que es también susceptible a la hipoacusia relacionada con la edad.17
Reed et al17 observaron una fuerte relación entre la hipertensión en pacientes de mediana edad e hipoacusia a frecuencias más altas. Carrasco et al15, en 1990 demostraron mediante métodos histoquímicos la presencia de terminaciones nerviosas adrenérgicas en las arteriolas terminales y radiales cuyas ramas nutren la estría vascular de la cóclea de ratas, así mismo en este estudio establecen la presencia y distribución de receptores adrenérgicos en la microcirculación coclear y observaron la vasoconstricción arteriolar tras la administración intravascular de agonistas alfadrenérgicos.
En el estudio realizado por Duck et al16 se apoya la hipótesis de que el daño coclear está intensificado en el contexto de HTA concomitante32. De igual manera, esta hipótesis fue verificada en un estudio en animales mediante la elevación significativa de la pérdida media de células ciliadas en la cóclea del grupo de ratas con DM insulinodependiente e HTA, en comparación con las ratas DM insulinodependientes normotensas. De la misma forma se encontraron diferencias estadísticamente significativas en la pérdida de audición en pacientes con DM insulinodependientes e HTA con respecto a los pacientes con DM insulinodependiente con tensión arterial normal.
A partir de estos resultados parece razonable apoyar la hipótesis de que la HTA es un factor de riesgo para pérdida de audición en frecuencias agudas. Besser et al37. Al estudiar la relación con las enfermedades cardiovasculares, encuentran que individuos diagnosticados de HTA tenían una odds de 1.5 con respecto a los individuos sanos, e incluso mencionan una relación lineal entre la presión sanguínea y la pérdida de audición, en la que por cada 1mmHg hay un incremento de pérdida de audición de 0.03 dB HL.
De la misma forma existen varios estudios sobre la asociación de la exposición al ruido y el desarrollo de HTA y pérdida de audición32. En 1990 Talbott et al,19 describe la relación existente entre la exposición al ruido ocupacional, la pérdida auditiva inducida por ruido y la HTA.
Chan et at20 en 2011, realiza un estudio transversal, donde se expone que existe una asociación entre la exposición prolongada al ruido ocupacional y el aumento de la incidencia de HTA. Chan explica que el ruido es un factor de estrés psicológico que produce una activación del eje hipotálamo-hipofisario-adrenal y del sistema nervioso simpático. Esto causa un aumento en los niveles de adrenalina, noradrenalina y cortisol, y estas tres hormonas influyen en la regulación de la presión arterial.24,25,26
Muchos estudios han sugerido que la exposición al ruido laboral se asocia a una elevación mantenida de la presión arterial o a un mayor riesgo significativo de HTA11,21-23,28-30,32,34. Otros sin embargo no encuentran que esta relación sea estadísticamente significativa19,27. Esta diferencia puede atribuirse al grado de protección auditiva de los trabajadores de manera que los niveles de ruido exterior no son en realidad la verdadera intensidad de exposición al ruido del oído interno.20
Tarter et al31 encontró que la exposición a niveles de ruido ≥ 85 dB durante más de 5 años se asoció con una pérdida auditiva de 28.3 dB a 4 kHz entre los trabajadores de ensamblaje automotriz.
De igual forma Chan en su estudio describe que hay una mayor prevalencia de HTA en los grupos de pérdida de audición en frecuencias agudas y medias. Así mismo un aumento de prevalencia de HTA en los grupos poblacionales mayores de 40 años, concluye en su estudio que la pérdida de audición inducida por el ruido estaba significativamente asociada a la HTA después de controlar los posibles riesgos concomitantes, que la pérdida de audición en frecuencias agudas es un buen biomarcador de exposición al ruido laboral y que los umbrales auditivos que exceden de 15dB en 4kHz o 6kHz en > 5 años se asocia a un aumento del riesgo de HTA, pero que este riesgo desaparece cuando se utiliza protección auditiva (tapones).
Por todo ello, se concluye que:
- La HTA es un importante factor de riesgo de la hipoacusia neurosensorial de altas frecuencias.
- La presbiacusia se asocia a una inadecuada microcirculación. La HTA causa una microangiopatía que compromete el flujo cochera e intensifica el daño cochera aumentando la perdida auditiva que sucede por la edad.
- La exposición mantenida al ruido laboral se asocia a una elevación mantenida de la presión arterial o a un mayor riesgo de HTA. Este riesgo disminuye con protección auditiva.
- El perfil audiométrico en la población hipertensa crónica controlada es similar al de la población general.
- La HTA asociada a otras comorbilidades como dislipemia o diabetes mellitus, empeora mas aún la audición en las personas mayores.
Referencias Hipertensión arterial
- Organización Mundial de la Salud. Informe sobre la situación mundial de las enfermedades no transmisibles 2014.
- Hansen CC. Perceptive hearing loss and arterial hypertension. Arch Otolaryngol. 1968;87(2):119–122.
- Przewo?ny T, Gójska-Grymaj?o A, Kwarciany M, G?secki D, Narkiewicz K. Hypertension and cochlear hearing loss. Blood Press. 2015;24(4):199–205.
- Chen YL, Ding YP. Relationship between hypertension and hearing disorders in the elderly. East Afr Med J. 1999;76(6):344–347.
- Torre P 3rd, Cruickshanks KJ, Klein BE, Klein R, Nondahl DM. The association between cardiovascular disease and cochlear function in older adults. J Speech Lang Hear Res. 2005;48(2):473–481.
- Tan TY, Rahmat O, Prepageran N, Fauzi A, Noran NH, Raman R. Hypertensive retinopathy and sensorineural hearing loss. Indian J Otolaryngol Head Neck Surg. 2009;61(4):275–279.
- Nazar J, Otalora F, Acevedo l. Audición del paciente hipertenso crónico controlado Rev. otorrinolaringol. cir. cabeza cuello;52(2):97-104, ago. 1992.
- Borg E. Noise-induced hearing loss in normotensive and spontaneously hypertensive rats. Hear Res. 1982;8(2):117–130.
- de Moraes Marchiori LL, de Almeida Rego Filho E, Matsuo T. Hypertension as a factor associated with hearing loss. Braz J Otorhinolaryngol. 2006;72(4):533–540.
- Agarwal S, Mishra A, Jagade M, Kasbekar V, Nagle SK. Effects of hypertension on hearing. Indian J Otolaryngol Head Neck Surg. 2013;65(Suppl 3):614–618.
- Wang B, Han L, Dai S, et al. Hearing Loss Characteristics of Workers with Hypertension Exposed to Occupational Noise: A Cross-Sectional Study of 270,033 Participants. Biomed Res Int. 2018;2018:8541638.
- Tachibana M, Yamamichi I, Nakae S, Hirasugi Y, Machino M, Mizukoshi O. The site of involvement of hypertension within the cochlea. A comparative study of normotensive and spontaneously hypertensive rats. Acta Otolaryngol. 1984;97(3-4):257–265.
- Makishima K. Arteriolar sclerosis as a cause of presbycusis. Otolaryngology. 1978;86(2):ORL322–ORL326.
- Esparza CM, Jáuregui-Renaud K, Morelos CM, et al. Systemic high blood pressure and inner ear dysfunction: a preliminary study. Clin Otolaryngol. 2007;32(3):173–178.
- Carrasco VN, Prazma J, Faber JE, Triana RJ, Pillsbury HC. Cochlear microcirculation. Effect of adrenergic agonists on arteriole diameter. Arch Otolaryngol Head Neck Surg. 1990;116(4):411–417.
- Duck SW, Prazma J, Bennett PS, Pillsbury HC. Interaction between hypertension and diabetes mellitus in the pathogenesis of sensorineural hearing loss. Laryngoscope. 1997;107(12 Pt 1):1596–1605.
- Reed NS, Huddle MG, Betz J, et al. Association of Midlife Hypertension with Late-Life Hearing Loss. Otolaryngol Head Neck Surg. 2019;161(6):996–1003.
- Ohlemiller KK. Mechanisms and genes in human strial presbycusis from animal models. Brain Res. 2009;1277:70–83.
- Talbott EO, Findlay RC, Kuller LH, et al. Noise-induced hearing loss: a possible marker for high blood pressure in older noise-exposed populations. J Occup Med. 1990;32(8):690–697.
- Chang TY, Liu CS, Huang KH, Chen RY, Lai JS, Bao BY. High-frequency hearing loss, occupational noise exposure and hypertension: a cross-sectional study in male workers. Environ Health. 2011;10:35. Published 2011 Apr 25.
- Rosenlund M, Berglind N, Pershagen G, Järup L, Bluhm G. Increased prevalence of hypertension in a population exposed to aircraft noise. Occup Environ Med. 2001;58(12):769–773.
- Leon Bluhm G, Berglind N, Nordling E, Rosenlund M. Road traffic noise and hypertension. Occup Environ Med. 2007;64(2):122–126.
- Jarup L, Babisch W, Houthuijs D, et al. Hypertension and exposure to noise near airports: the HYENA study [published correction appears in Environ Health Perspect. 2008 Jun;116(6):A241]. Environ Health Perspect.
- Spreng M. Central nervous system activation by noise. Noise Health. 2000;2(7):49–58.
- Babisch W. The Noise/Stress Concept, Risk Assessment and Research Needs. Noise Health. 2002;4(16):1–11.
- Ising H, Kruppa B. Health effects caused by noise: evidence in the literature from the past 25 years. Noise Health. 2004;6(22):5–13.
- Hirai A, Takata M, Mikawa M, et al. Prolonged exposure to industrial noise causes hearing loss but not high blood pressure: a study of 2124 factory laborers in Japan. J Hypertens. 1991;9(11):1069–1073.
- Kuang D, Yu YY, Tu C. Bilateral high-frequency hearing loss is associated with elevated blood pressure and increased hypertension risk in occupational noise exposed workers. PLoS One. 2019;14(9):e0222135. Published 2019 Sep 5.
- Zhou F, Shrestha A, Mai S, et al. Relationship between occupational noise exposure and hypertension: A cross-sectional study in steel factories. Am J Ind Med. 2019;62(11):961
- Liu J, Xu M, Ding L, et al. Prevalence of hypertension and noise-induced hearing loss in Chinese coal miners. J Thorac Dis. 2016;8(3):422–429.
- Tarter SK, Robins TG. Chronic noise exposure, high-frequency hearing loss, and hypertension among automotive assembly workers. J Occup Med. 1990;32:685–689.
- Besser J, Stropahl M, Urry E, Launer S. Comorbidities of hearing loss and the implications of multimorbidity for audiological care. Hear Res. 2018;369:3–14.
- Umesawa M, Sairenchi T, Haruyama Y, Nagao M, Kobashi G. Association between hypertension and hearing impairment in health check-ups among Japanese workers: a cross-sectional study. BMJ Open. 2019;9(4):e028392. Published 2019 Apr 24.
- Meneses-Barriviera CL, Bazoni JA, Doi MY, Marchiori LLM. Probable Association of Hearing Loss, Hypertension and Diabetes Mellitus in the Elderly. Int Arch Otorhinolaryngol. 2018;22(4):337–341.
- Bao M, Song Y, Cai J, Wu S, Yang X. Blood Pressure Variability Is Associated with Hearing and Hearing Loss: A Population-Based Study in Males. Int J Hypertens. 2019;2019:9891025. Published 2019 Feb 3.
- Rosen S, Plester D, El-Motfy A, Rosen HV. Relation of hearing loss to cardiovascular disease. Trans Am Acad Ophthalmol Otolaryngol. 1964; 68:433-444.
- Besser J, Stropahl M, Urry E, Launer S. Comorbidities of hearing loss and the implications of multimorbidity for audiological care. Vol. 369, Hearing Research. Elsevier B.V.; 2018. p. 3–14.
Factores de riesgo metabólico: Conclusiones
En conclusión, los factores cardiovasculares han sido ampliamente estudiados en relación con la pérdida de audición, y concretamente con la pérdida de audición asociada a la edad, encontrándose asociaciones significativas con muchos de ellos, especialmente con la diabetes mellitus y la hipertensión arterial. No obstante, también encontramos estudios que no apoyan esa asociación, y en algunos casos, aunque puedan resultar estadísticamente significativas, no son clínicamente relevantes.

